要计算原子的形式电荷,我们从以下步骤开始:
评估中性原子的价电子数(),例如硼 3 个,碳 4 个,氮 5 个等。(注:这也相当于有效核电荷 ,即价轨道上的电子“看到”的由内层电子屏蔽的质子数。)
计算原子上的非键合价电子数()。每对孤对电子计为 2 个,每个单电子计为 1 个。
计算与原子相连的键数(),或者计算键合电子数并除以 2。
然后通过从 中减去和来计算形式电荷。
(等价于 )
如果所有信息都给出了,计算相当直接。然而,为了简洁起见,很多时候孤对电子和 键并不会明确画出。
因此,部分技巧在于在必须考虑隐含的孤对电子和键的情况下计算形式电荷。
在下面的文章中,我们将讨论许多这样的情况。我们还会提醒你,在哪些情况下原子的计算形式电荷并不一定能很好地指示其反应性,这一点在未来极其重要。
目录
- 形式电荷
- 首行元素的简单示例
- 在没有给出所有细节时计算形式电荷
- 一些经典的形式电荷问题
- 形式电荷和曲线箭头
- 卤素
- 结论
- 注释
- 自测
- (高级)参考文献及深入阅读
1. 形式电荷
形式电荷是一种用于计算的手段,用于为特定原子分配一个电荷。
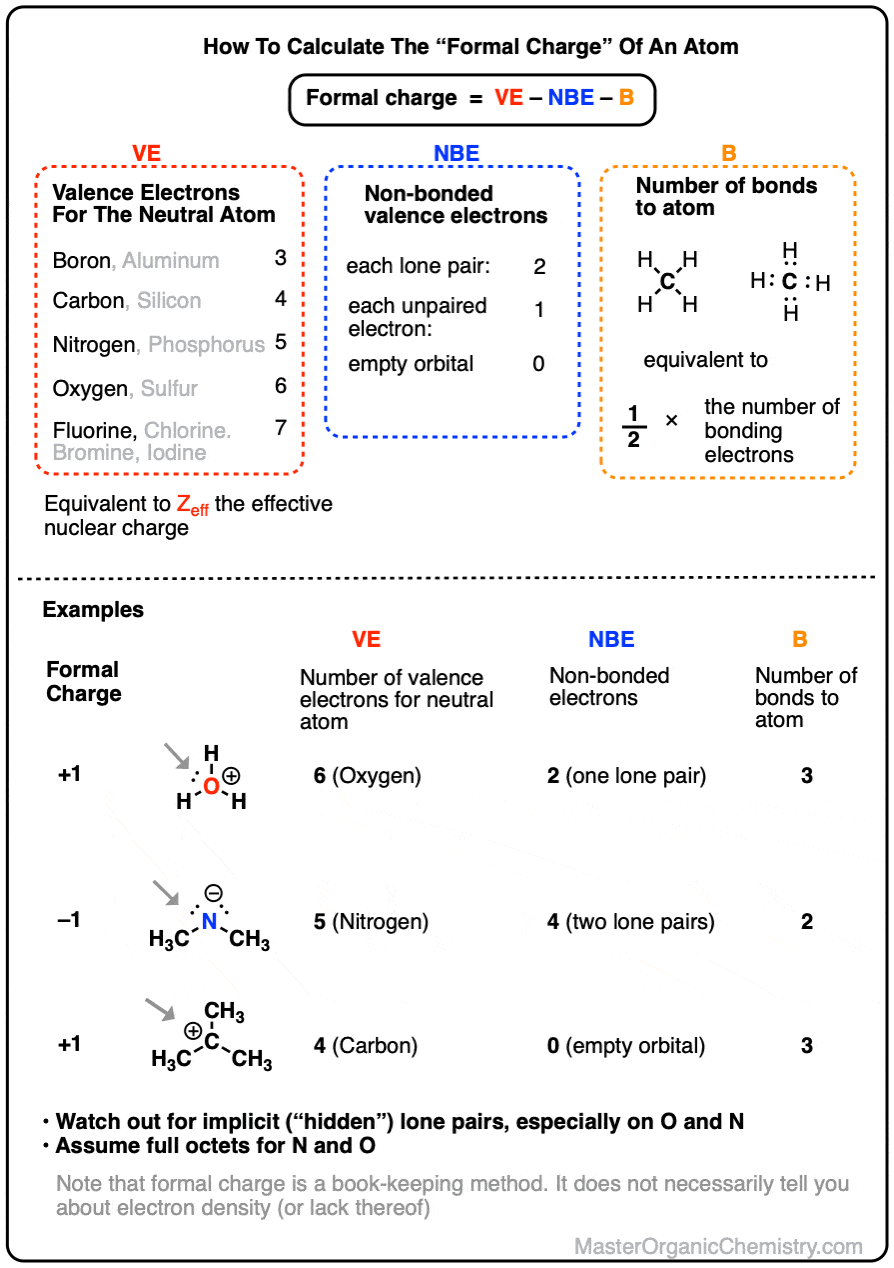
要获得原子的形式电荷,我们首先计算中性原子的价电子数 [1],然后从中减去它“拥有”的电子数(即孤对电子或单占轨道中的电子)以及它分享的电子数的一半(即键合电子数的一半,相当于键数)。
计算形式电荷()的最简单方式是:
其中
- VE对应于中性原子周围的电子数(硼3个,碳4个,氮5个,氧6个,氟7个)
- NBE对应于原子周围的非键合电子数(孤对为2个,单占轨道为1个,空轨道为0个)
- B是原子周围的键数(相当于键合电子数的一半)
之所以称为“形式”电荷,是因为它假设所有键合电子均等共享。它没有考虑电负性差异(即偶极)。
因此,形式电荷并不总是一个指导电子在分子中实际位置的好方法,也可能是一个不可靠的反应性指导。我们将在下面进一步讨论这一点。
2. 首行元素的简单示例
当所有孤对电子都为你绘制出来时,计算形式电荷相对直接。
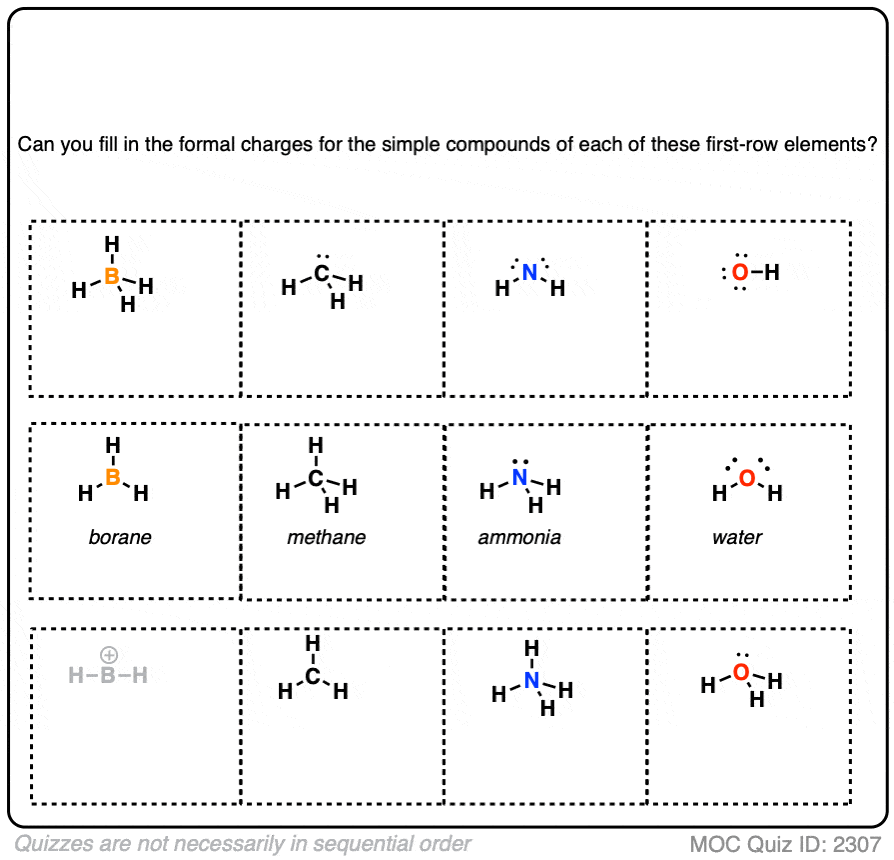
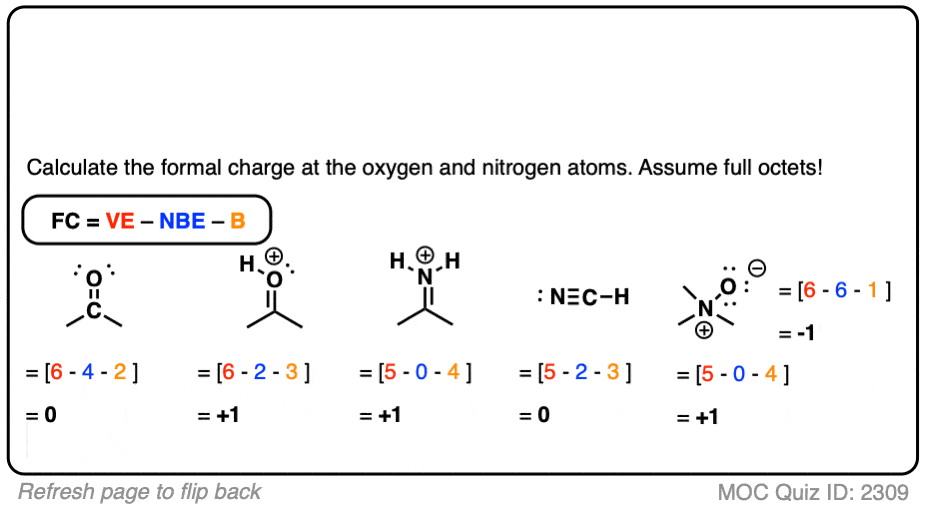
让我们来看下面测验中的第一个例子。
在水合氢离子()中,中心原子是氧,中性原子有 6 个价电子
中心原子有 2 个非配对电子和 3 个键
氧上的形式电荷为 ,得到
看看你能否为下面的例子填写剩余部分。
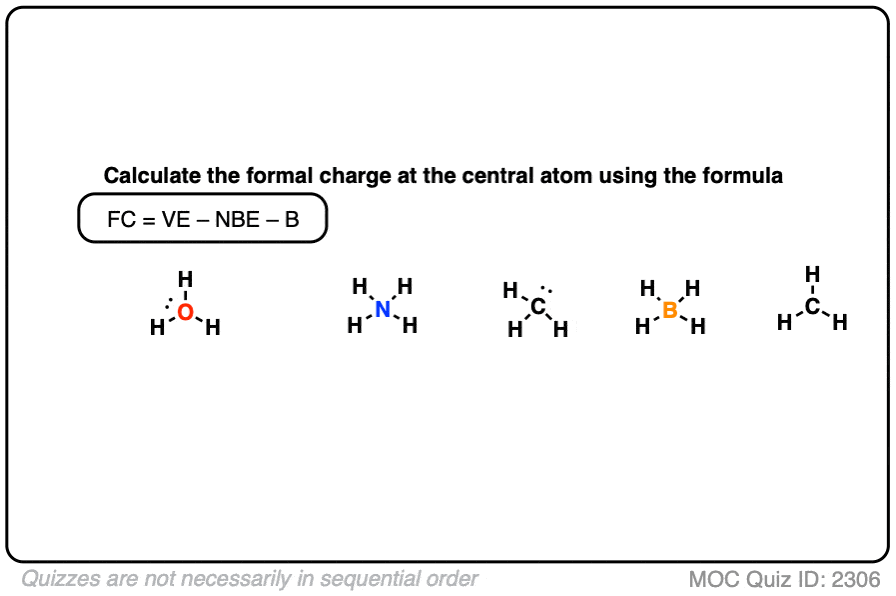
点击此处查看答案
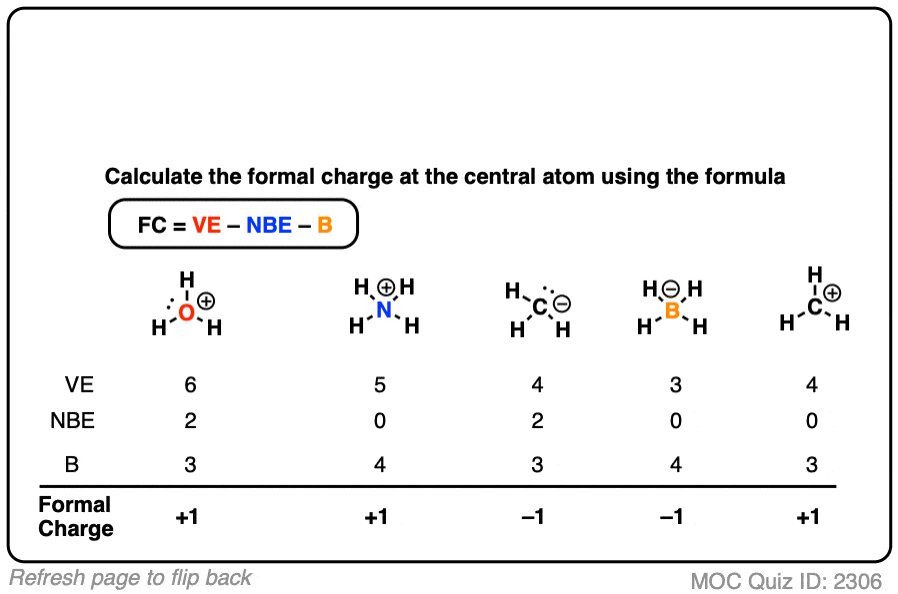
如果进行得不错,你可以尝试为这个表中的所有例子填写形式电荷。
习惯计算形式电荷需要一段时间,但过后你会被认为理解如何计算形式电荷,并能识别出原子将具有形式电荷的结构。
让我们处理一些稍微棘手的情况。
3. 在没有给出所有细节时计算形式电荷
当我们画一个火柴人而不画出他们的手指时,这并不意味着我们在画一个骷髅。我们只是假设你在真正需要时可以填补手指,但为了节省时间而跳过这一步。
键线式就像火柴人。它们省略了很多细节,但仍然假设你知道某些事物存在。
对于碳,我们经常省略绘制氢原子。你仍然应该知道它们在那里,并根据需要添加足够的氢原子以形成完整的八隅体(或者如果是碳正离子,则是六隅体)。
如果碳上有孤对电子或非配对电子,它总是被绘制出来。
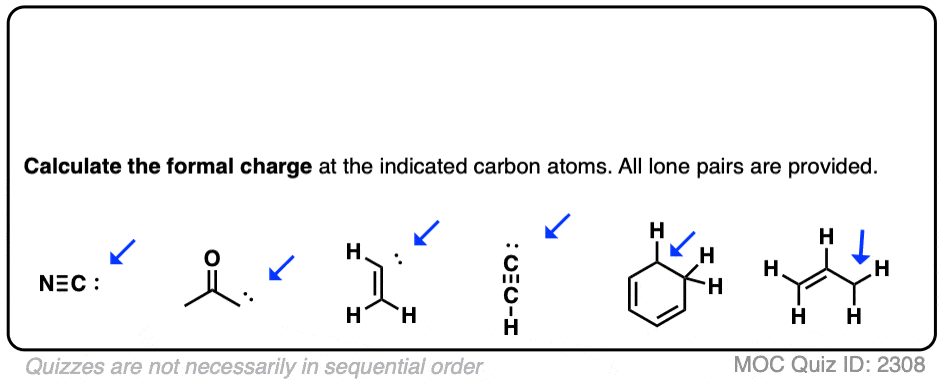
点击此处查看答案
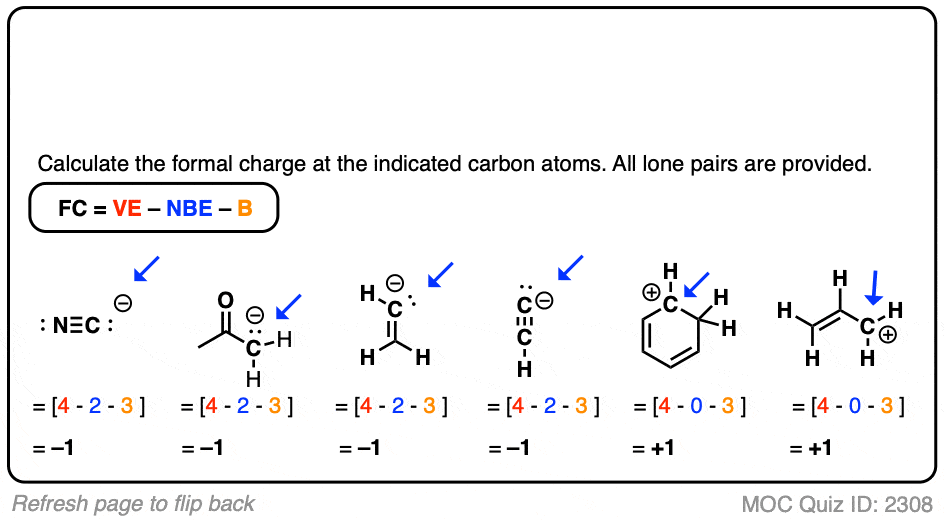
需要注意的一点。如果我们绘制一个键线式,并且确实绘制了手指,而且只画了 3 个,那么我们可以安全地假设这个人确实只有 3 个手指。所以在测验的最后两个例子中,我们不得不绘制氢原子,以便你知道这是一个碳正离子,否则你将不得不假设它有完整的八隅体!
氧和氮(以及卤素)的处理方式略有不同。
氢键总是被绘制出来。
经常省略的孤对电子。
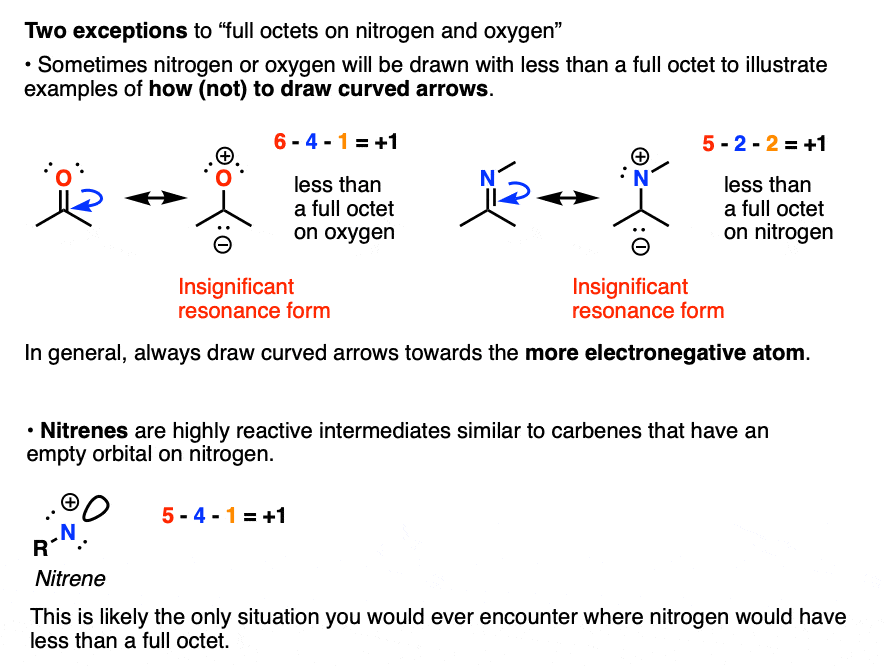
氮和氧总是有完整的八隅体。始终如此。但还是有两个例外 [2]
因此,即使孤对电子没有被绘制出来,也假设有足够的孤对电子使得形成完整的八隅体。当这些原子与氢的键缺失时,这确切地意味着:确实没有氢存在!
尝试这些例子:
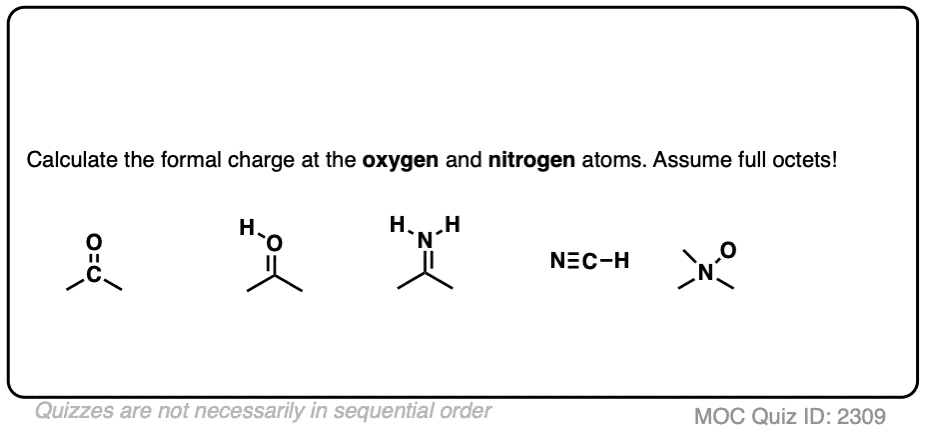
点击此处查看答案
现在看看你能否将这些例子结合起来!
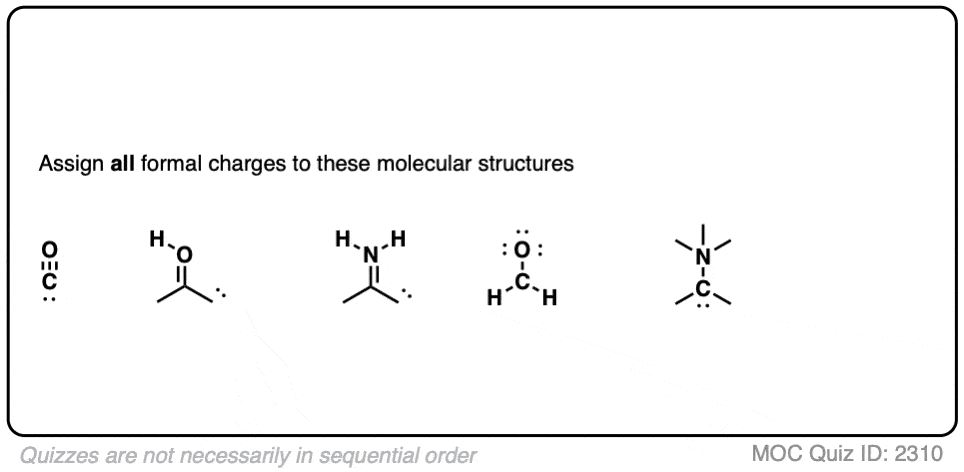
点击此处查看答案
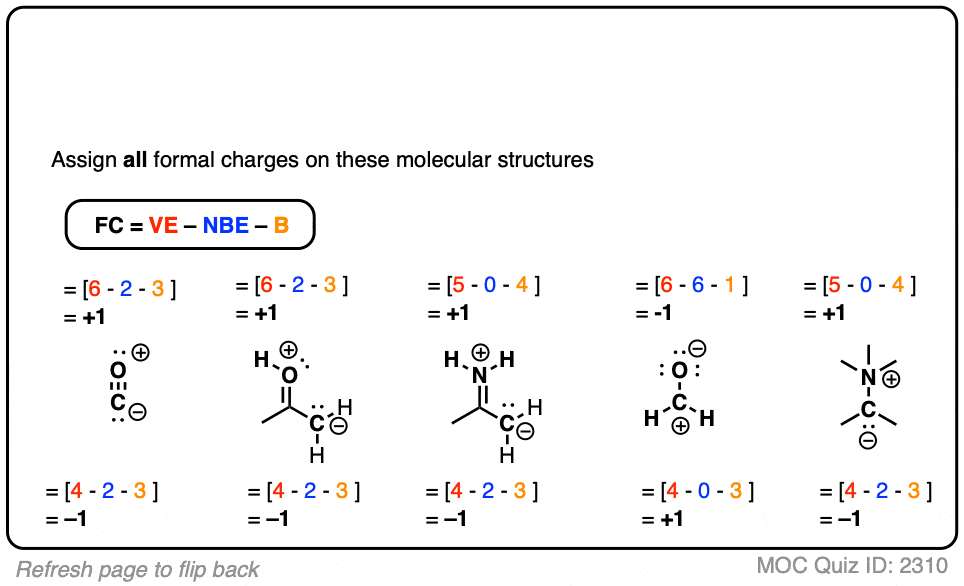
注意,其中一些并不是稳定的分子,而是在不同阶段你会遇到的共振形式!
4. 一些经典的形式电荷问题
我们可以使用上述相同的形式电荷公式,结合隐含的孤对电子和氢的规则,来计算一些看起来非常奇特的分子中原子的形式电荷。
以下是一些经典的形式电荷问题。
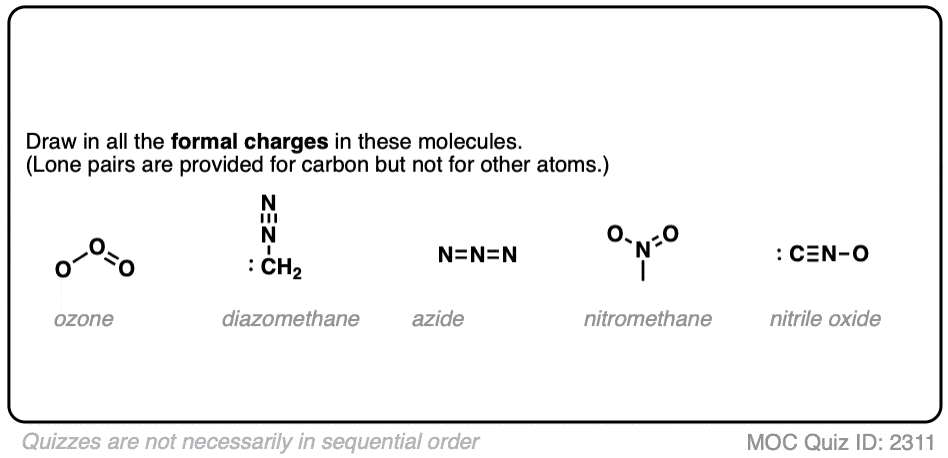
点击此处查看答案
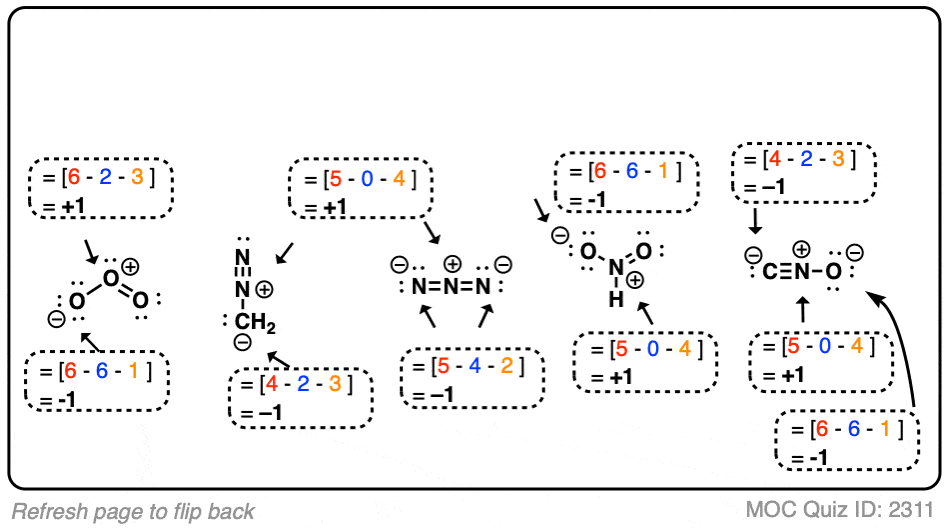
注意,尽管结构可能看起来奇怪,形式电荷的公式保持不变。
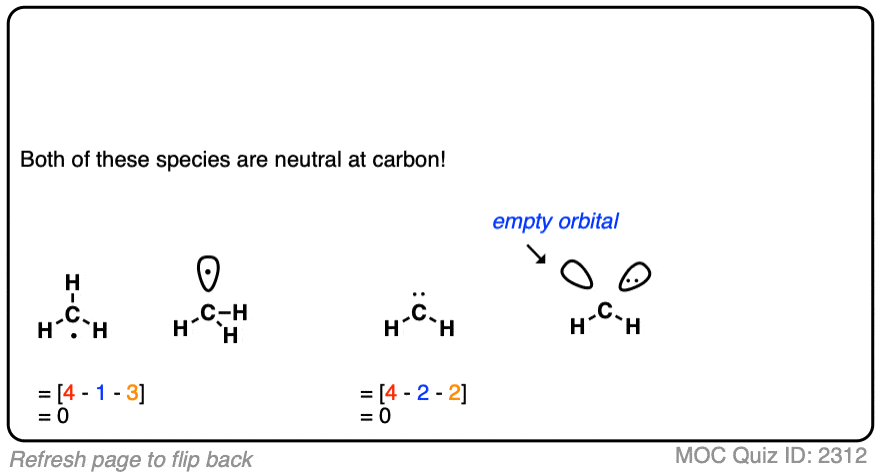
形式电荷的公式甚至可以应用于后期我们将遇到的一些相当奇特的反应中间体。
不要被吓到。只需计算电子数和键数,就能找到正确的答案。

点击此处查看答案
5. 形式电荷和曲线箭头
我们使用曲线箭头来展示反应中和共振结构中电子对的移动。
例如,这里有一个曲线箭头显示了氢氧根离子 与质子 的反应。
箭头显示了两个电子从氧移动以形成新的 键。
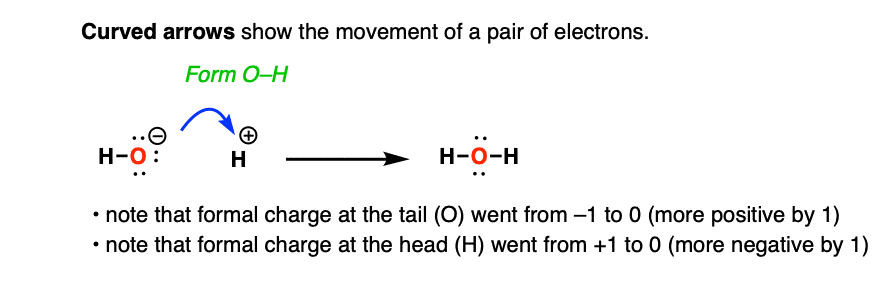
曲线箭头还有助于追踪形式电荷的变化。请注意,曲线箭头初始尾部的形式电荷(氧)变得更正(从 -1 变为 0),而曲线箭头最终尾部的形式电荷()变得更负(从 +1 变为 0)。
当酸加入水中时,我们会形成氢氧根离子,。
这里有个小测验。看看你能否画出从氢氧根离子到 的曲线箭头。
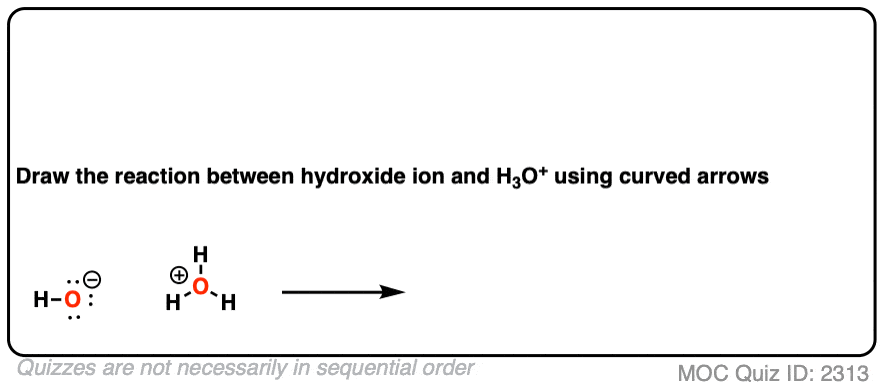
点击此处查看答案
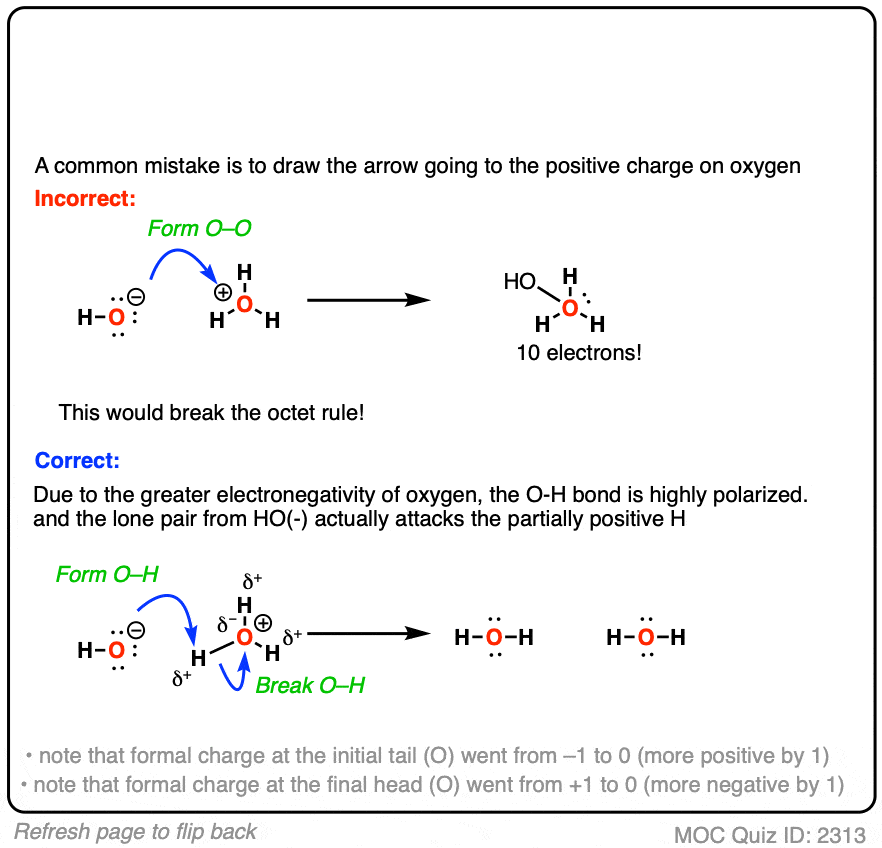
如果你成功了——恭喜!
但我敢打赌,至少有一小部分人将箭头画向了带正电的氧。
这有什么问题?
氧上没有空轨道可以接受孤对电子。如果你遵循曲线箭头的逻辑,那将导致形成一个新的 键,并在氧上有 10 个电子,打破了八隅体规则。
等一下,你可能会说:“我以为氧是带正电的?如果不在氧上发生反应,它应该在哪里反应?”
在氢上!毕竟, 是酸,对吧?
这很好地说明了为什么称它为“形式电荷”,以及形式电荷与静电荷(又称“偏电荷”或“电子密度”)不同的原因。
形式电荷最终是一种计算手段,有点像在运动会中将“胜利”分配给整个班级而不是某一个人。它没有考虑氧氢键中电子不等分享的事实,存在明显的偶极。
所以,尽管我们在氧上画了一个“形式”电荷,偏正电荷实际上都在氢上。尽管带有正的形式电荷,但带有部分负的静电荷。
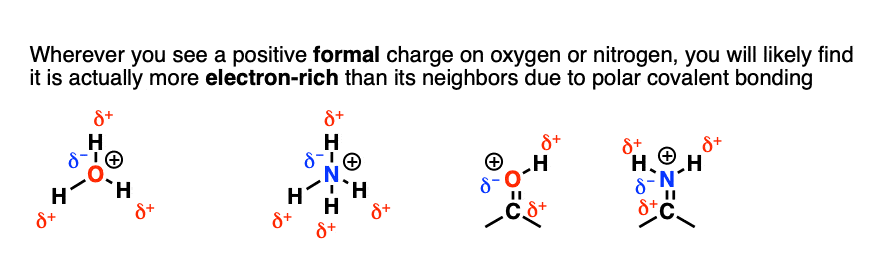
这就是为什么像 这样的碱会在 处反应,而不是 处。
再重申一遍:
氧和氮上的正电荷并不表示有空轨道。假设氧和氮都有完整的八隅体![2]
相比之下,碳上的正电荷则表示有空轨道。
6. 卤素
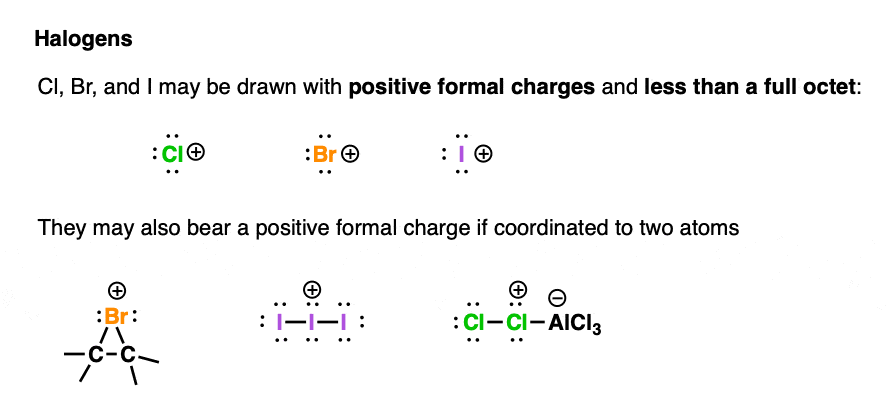
卤素上的正形式电荷主要分为两类。
我们经常会画出卤素离子 , 和 ,这些离子具有六个价电子和一个空轨道(但氟的 除外——它就像个贪婪的野兽一样)
可以认为这些离子带有一个空轨道,因为它们体积大且相对易极化。它们可以在相对较大的体积上分散正电荷。
这些离子可以从路易斯碱接受一对孤对电子,从而形成完整的八隅体。
,和也可以由于与两个原子键合而带有正形式电荷。
在这些情况下,重要的是要意识到卤素具有完整的八隅体,而不是空轨道。因此,它们不会直接从 碱那里接受一对电子;通常情况下,与卤素相邻的原子会接受电子。
7. 结论
如果你读到了最后并完成了所有测验,你应该已经为剩余部分中会看到的所有形式电荷示例做好了准备。
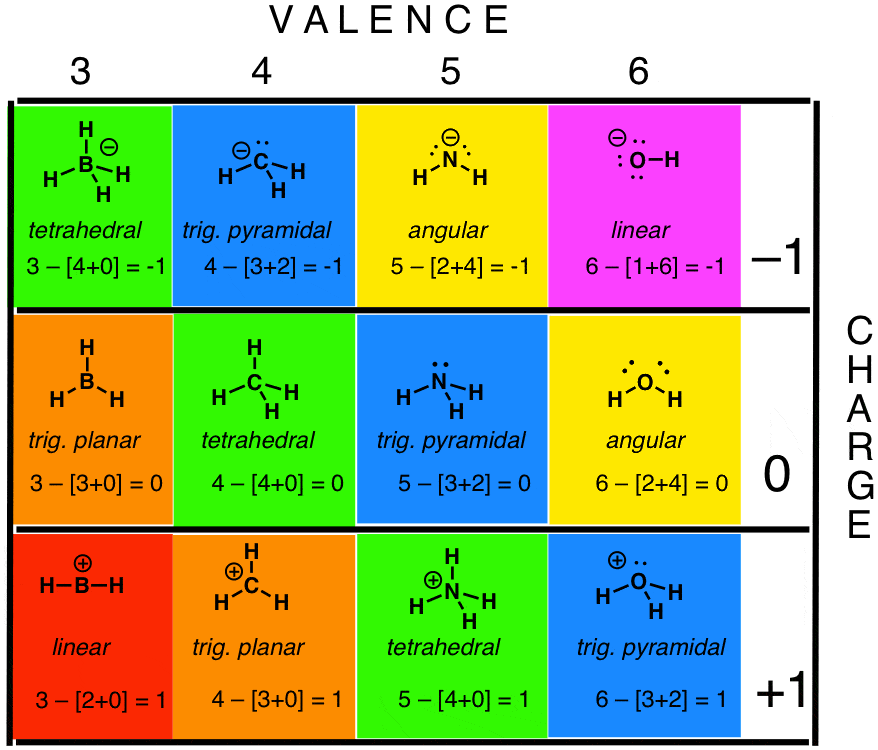
可以使用公式 来计算形式电荷
键线式经常省略孤对电子和 键。在计算形式电荷时要警惕这些情况。
带正电的碳具有空轨道,但假设带正电的氮和氧具有完整的八隅体。
水合氢离子 的例子显示了仅依靠形式电荷来理解反应性的危险。密切注意原子间的电负性差异,并画出偶极以真正了解它们的反应性。
自测
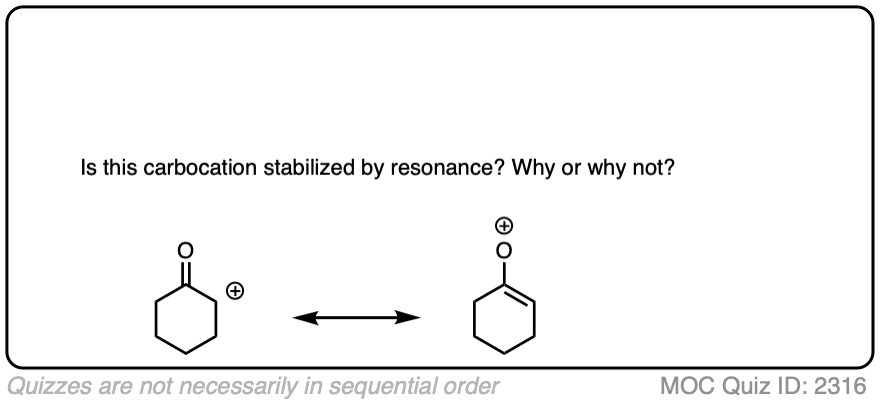
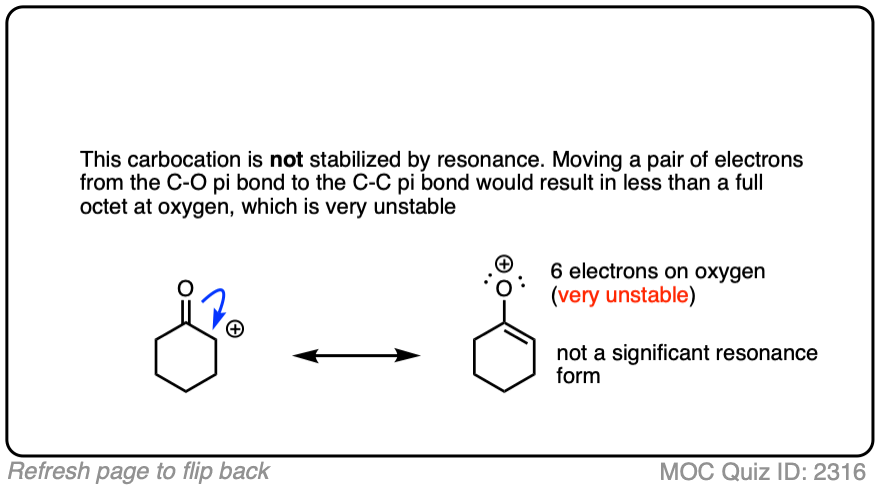
点击此处查看答案
[1] 使用“价电子”可以得到正确的答案。但如果你仔细想想,这其实并没有完全说得通。正电荷从哪里来?当然是来自于原子核中的带正电的质子!因此,这个方程中的“价电子”部分更恰当地被认为是价质子的代理——换句话说,就是“有效核电荷”;每个价电子从原子核感受到的电荷,不包括已填充的内层壳。
最后编辑:admin 更新时间:2024-08-30 09:54